Electricitatea statica
Materia electrica
a. Dezmebrarea materiei
Experimentele pe care le-am discutat pina acum ne-au sugerat ca in orice corp se gasesc atit sarcini pozitive cit si sarcini negative, sarcina totala fiind, in conditii normale, zero. Dar este cu adevarat asa?
Cind un copil primeste o jucarie noua, apare o dorinta aproape irezistibila de a afla din ce este facuta si cum sunt asamblate partile componente. Singurul mod de a raspunde acestei curiozitati este dezmembrarea obiectului, chiar daca refacerea lui in starea initiala este mai intodeauna imposibila. Aceeasi metoda poate fi aplicata, intr-un experiment imaginar, ca sa aflam din ce sunt formate corpurile ce ne inconjoara.
Putem transforma o substanta solida, cum este cuprul, in pulbere din ce in ce mai fina. Minusculele particule de pulbere pot fi identificate ca fiind, in continuare, cupru: cu ele putem sa obtinem, prin reactii chimice de combinare cu alte substante, exact substantele pe care le obtineam folosind cuprul masiv. Toate proprietatile chimice au fost pastrate. De asemenea, exista procedee fizice ce permit identificarea fara dubiu a cuprului, de exemplu analiza luminii emise in anumite procese. Continuam divizarea substantei in particule inca si mai mici si obtinem, in continuare, particule de cupru. Putem face asta la nesfirsit, putem obtine particule de cupru oricit de mici dorim? Experimentele arata ca nu: exista un prag in dezmembrare. Cu fragmentele obtinute dincolo de acest prag nu mai putem determina substanta din care au provenit. Ultimele particule (cele mai mici) ce mai pastreaza inca proprietatile substantei au fost numite atomi.
Sa pornim din nou experimentul de dezmembrare, de data asta cu mai multe "substante", sa zicem cupru, apa, si aer. Din fiecare luam aceeasi masa, 1 miligram, cam cit cintareste un graunte de nisip. Pentru a fi exacta, cintarirea trebuie ferita de actiunea aerului inconjurator; ea trebuie efectuata in vid. Datorita densitatlor diferite, va trebui sa luam cam 0,1 mm3 de cupru, 1mm 3 de apa si aproximativ 1 cm3 de aer.
In privinta cuprului, lucrurile stau cel mai simplu. Divizind in bucati din ce in ce mai mici, la un moment dat obtinem niste fragmente, toate fiind aproape identice intre ele. Ele sunt in continuare cupru. Spargerea lor ar produce doar particule ce nu mai pot fi identificate drept cupru. Numim atomi de cupru acele ultime fragmente, care mai au inca proprietatile cuprului. In desenul a) al figurii de mai jos am figurat atomii de cupru prin niste bile colorate de dimensiuni macroscopice, si vom face acelasi lucru si pentru ceilalti atomi. Trebuie sa accentuam ca este doar o reprezentare ultra-simplificata.
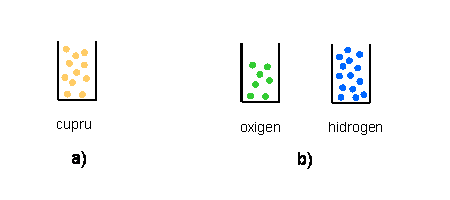
Cu apa este un pic mai complicat. Aflam mai intii ca apa este compusa din alte doua substante, pe care chimistii le numesc oxigen si hidrogen. Putem descompune apa in aceste substante si putem recombine, la loc, oxigenul si hidrogenul, pentru a obtine apa. Cu astfel de transformari, numite reactii chimice, se ocupa chimia. Pentru ca nu puteau descompune oxigenul si hidrogenul, prin reactii chimice, in altceva, chimistii au numit aceste substante "substante elementare" sau "elemente". Cuprul este si el o substanta elementara. Intorcindu-ne la actiunea noastra de dezmembrare, constatam ca din miligramul de apa cu care am pornit obtinem 0,89 miligrame de oxigen si 0,11 miligrame de hidrogen. Divizam apoi, separat, aceste substante simple, pina cind obtinem atomi de oxigen si atomi de hidrogen, ca in desenul b) al figurii de mai sus. Pentru fiecare atom de oxigen avem exact doi atomi de hidrogen.
Cel mai complex este cazul aerului. Acesta este un amestec de multe substante. Masa cea mai mare o are azotul, trei sferturi din cit cintareste tot amestecul. Mai gasim oxigen, dioxid de carbon si multe alte substante, printre care multe produse poluante ale activitatii umane. Descompunem substantele compuse (cum este dioxidul de carbon) in substante elementare si apoi divizam in atomi fiecare substanta elementara. Obtinem o colectie de atomi de foarte multe tipuri: atomi de oxigen, atomi de azot, atomi de carbon, etc. Ne trebuie foarte multe cutiute pentru a aranja separat aceste tipuri de atomi.
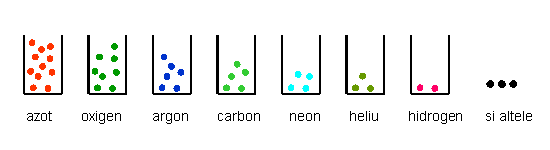
Inainte sa facem ultimul pas in experimentul de dezmembrare, sa recapitulam unde am ajuns. Din cupru am obtinut atomi de cupru. Din apa am obtinut doua feluri de atomi, de oxigen si de hidrogen. Din aer am obtinut o multime de tipuri de atomi. Ne pregatim, pentru fiecare din cele trei locuri de lucru (cupru, apa, aer), foarte multe cutiute in care vom clasifica particulele pe care le vom obtine. Si, in sfirsit, dezmembram atomii.
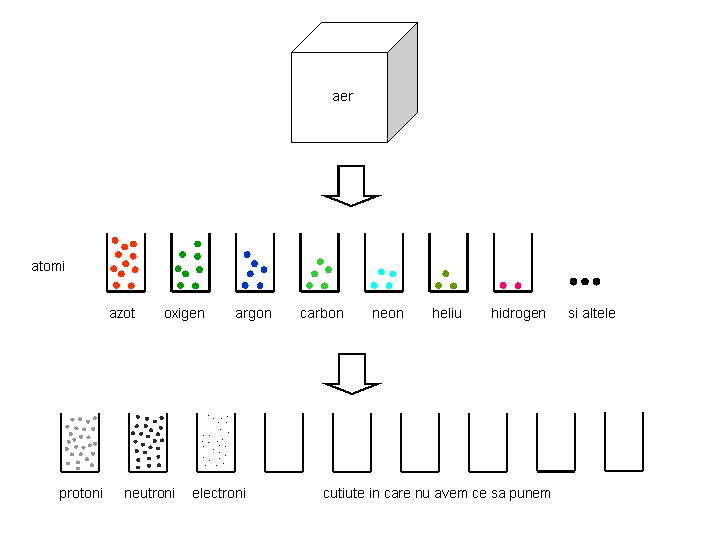
Rezultatul este neasteptat. Din multitudinea de tipuri de atomi, obtinem numai trei tipuri de particule subatomice. Fizicienii le-au numit protoni, neutroni si electroni. Putem incerca experimentul cu orice material cunoscut: nu obtinem altceva decit protoni, neutroni si electroni. Voi insiva sunteti construiti doar din aceste trei particule. Mai mult, indiferent de atomii de unde au fost obtinuti, toti protonii sunt perfect identici intre ei. Un proton scos din atomul de cupru poate inlocui un proton din atomul de carbon fara ca sa existe vreo posibilitate sa detectam o modificare. Acelasi lucru se intimpla cu neutronii si cu electronii, toti neutronii sunt identici intre ei, toti electronii sunt identici intre ei.
Sa ne uitam, mai intii, la masele lor. Masa unui proton este foarte apropiata de masa unui neutron, fiind mai mica decit aceasta doar cu mai putin de doua miimi. Spre deosebire de aceste particule masive, electronul este foarte usor avind o masa de aproape 2000 mai mica.

Avem, deci, pentru fiecare dintre "substantele" cu care am pornit (cupru, apa si aer), doar cite trei cutiute cu particule, una cu protoni, una cu neutroni si una cu electroni. Sa ne uitam acum la numarul lor. Acesta este imens, ceea ce arata diferenta fantastica de scara de marime intre lumea atomilor si lumea ce ne este familiara. Indiferent ca am descompus cupru, apa sau aer, numarul de protoni nu este prea diferit de numarul de neutroni. Pentru un miligram de substanta acesta este in jur de 3 urmat de 22 de zerouri ! Daca impartim numarul de protoni dintr-un miligram de substanta, in mod egal, la toti locuitorii Pamintului, numarul primit de fiecare ar fi inca imens, 50 de milioane de milioane de protoni.
Cu tot numarul lor imens, o egalitate exacta poate fi constatata intre numarul de electroni si cel de protoni: pentru fiecare proton avem un electron si numai unu. Aceasta egalitate are loc, separat, pentru atomii oricarui element, si pentru orice cantitate din acel element.
Din cauza masei lor mici si numarului egal cu cel al protonilor, electronii contribuie foarte putin la masa oricarei substante, aproximativ 99,9% fiind contributia particulelor masive (protoni si neutroni).

