Electricitatea statica
Materia electrica
c. Reasamblind substantele
Am dezmebrat, intr-un experiment imaginar, materia obisnuita (cea din care sunt alcatuite toate corpurile). Numim "imaginar" experimentul nu pentru ca acesta ar fi imposibil, ci pentru ca, din cauze ce vor deveni evidente pe parcurs, acesta nu poate fi efectuat chiar asa cum l-am descris. Am aflat, de exemplu, ca punerea intr-o "cutiuta" a protonilor dintr-un miligram de materie ar produce forte de repulsie imense, ce ar spulbera recipientul. De asemenea, fizicienii stiu astazi ca, scosi din nucleu, neutronii nu sunt stabili si se dezintegreaza, producind alte particule. Afara din nucleu, numarul de neutroni scade continuu, injumatatindu-se la fiecare sfert de ora.
Din dezmembrarea atomilor am obtinut protoni, electroni si neutroni. Ne propunem acum sa parcurgem drumul invers, sa reconstruim imaginar atomii, moleculele si, in final, substantele de la care am plecat. Mai intii, reconstruim atomii. Daca am fost atenti in timpul dezmembrarii, avem pe undeva niste notite. Oricum, reteta este simpla, mai simpla decit una pentru prajituri. Vreti atomi de hidrogen, cupru, oxigen, carbon? Iata de ce aveti nevoie:

Numarul de protoni este, de fapt, cel care identifica elementul chimic: daca e 8 avem oxigen, daca e 6 avem carbon, etc.. De aceea el este numit numar atomic, fiind notat cu Z. Pentru ca atomul sa fie neutru, trebuie sa adaugati un numar egal de electroni. Despre numarul de neutroni vom vorbi mai jos.
Sa vedem ce facem cu aceste ingrediente. Protonii si neutronii (particulele masive) trebuie grupate intr-un volum foarte mic, formind nucleul atomului. Din acest motiv, aceste particule mai sunt numite nucleoni. In nucleu este concentrata aproape toata masa atomului, peste 99,9% din aceasta. Nucleonii sunt tinuti laolalta de niste forte mult mai puternice decit cele electrice, numite forte nucleare tari. Spre deosebire de cele gravitationale si electrice, fortele nucleare au o raza de actiune extrem de scurta. Ele nu actioneaza in afara nucleului. Pentru un anumit numar de protoni, numarul de neutroni este esential: nucleul poate sa fie stabil (sa dureze "vesnic") sau instabil (de exemplu, sa se transforme, pe neasteptate, fara nici un alt motiv, emitind radiatie nucleara, in nucleul stabil al altui element). Diferitele variante ale unui element sunt numite izotopi. Acestia sunt identificati dupa numarul total de nucleoni, numit numar de masa si notat cu A. Daca E este simbolul elementului, un anumit izotop este notat AZE. De multe ori este utilizata o notatie simplificata, constind din simbolul elementului si numarul de masa, de exemplu C12. Retetele date mai sus sunt pentru nuclee stabile. De exemplu, pentru carbon, reteta produce 126C sau 136C. Cu 6 protoni si 8 neutroni in nucleu ati obtine izotopul 146C, care este instabil.
A mai ramas sa punem electronii. Acestia sunt atrasi de catre nucleul pozitiv si se misca rapid in jurul acestuia. Putem sa consideram sarcina lor negativa ca formind un nor in jurul nucleului, densitatea norului scazind gradual spre periferie. Marimea norului electronic stabileste, de fapt, marimea atomului: cam de 100 de mii de ori mai mare decit a nucleului. Dimensiunea unui atom este de ordinul a 10-10 m iar a unui nucleu de ordinul a 10-15 m.

Atomul de carbon 12.
Puteti sa exersati "construirea" atomilor folosind simularea de mai jos. Dati un click pe imagine, descarcati si apoi lansati fisierul in executie. Apasati pe semnul - la "Element" ca sa ascundeti Tabelul periodic si pe plus ca sa vedeti simbolul, numarul de nucleoni si sarcina electrica a atomului pe care l-ati construit. La "Model" selectati "Nour" pentru vizualizarea electronilor ca un nor. Acum puteti incepe constructia: luati din recipiente protoni, neutroni si electroni si duceti-i in spatiul de lucru (in stinga, in jurul semnului x). Acolo va aparea numele atomului, daca este stabil sau instabil, daca este neutru, ion pozitiv sau ion negativ. Daca atomul este instabil, acesta va vibra si va trebui sa mai adaugati sau sa indepartati neutroni.
Pot fi atomii vazuti? Cu siguranta, vedem corpurile si toate nu sunt decit atomi. Dar pot fi vazuti ei individual? Lumina este un mijloc mult prea grosolan pentru a-i putea distinge. Atomii de la suprafata unui material solid pot fi "vazuti", totusi, indirect, prin interactia cu un virf extrem de ascutit. Astfel de instrumente se numesc microscoape de forta atomica (AFM) si, respectiv, microscoape cu efect tunel (STM). Marimile fortei de interactie sau ale unui curent electric sunt reprezentate prin nuante de culori (sau tonuri de gri) pentru fiecare punct de pe suprafata si imaginea obtinuta poate fi vazuta.

Microscopul de forta atomica. Forta este masurata prin deviatia unei raze laser reflectata de bara care sustine virful.
Imaginea unei suprafete de aur in care se pot distinge atomii, obtinuta prin microscopie cu efect tunel.
Din ce am spus pina acum s-ar putea intelege ca electronii sunt asezati "la gramada" in norul electronic pe care noi l-am desenat ca unul sferic. Realitatea este, insa, alta. Norul electronic are o structura stratificata, fiecare strat fiind alcatuit din substraturi. La rindul lor, substraturile sunt formate din zone, numite orbitali, unde se misca electronii. Mai jos aveti reprezentarea citorva orbitali, de tip s (sferic), p (urmatorii 2) si d.

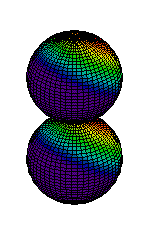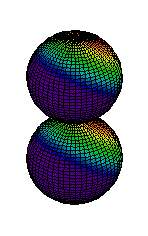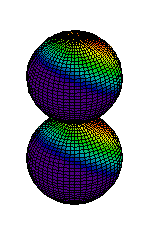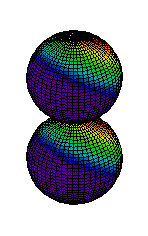


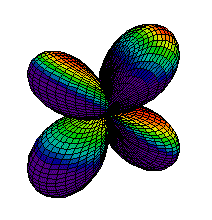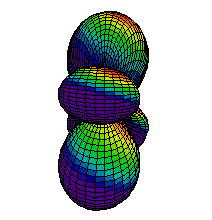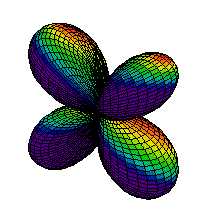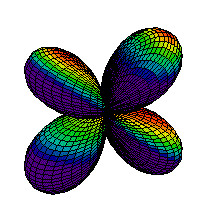

| Ocuparea straturilor se face de la cel mai apropiat de nucleu inspre exterior, astfel incit energia sa fie minima. Pe primul strat se pot gasi maximum 2 electroni, pe al doilea se pot gasi 8 electroni, pe al treilea 18 electroni, etc. Ultimul strat (cel mai indepartat de nucleu) care are electroni se numeste strat de valenta. Numarul electronilor de pe stratul de valenta este determinant pentru felul in care atomul stabileste legaturi chimice cu alti atomi. Din acest motiv, numarul atomic este esential pentru proprietatile chimice ale elementului respectiv. Heliul, cu numarul atomic 2, este un gaz intilnit in aerul atmosferic. Cu cei doi electroni ai sai, primul strat electronic este complet ocupat, electronii sunt strins legati de nucleu. Din acest motiv, heliul nu reactioneaza cu alte substante, fiind numit "gaz nobil". In atmosfera este intilnit sub forma de atomi. |  |
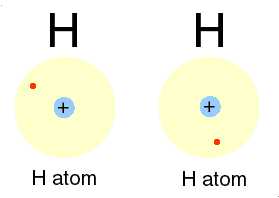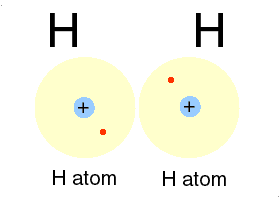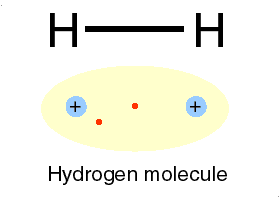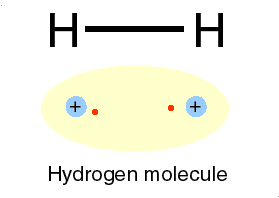
Un alt gaz intilnit in atmosfera este hidrogenul, cu numarul atomic 1. Avind un singur electron, primul strat nu este complet ocupat si legatura intre electron si nucleu este mai slaba. Hidrogenul atomic este, astfel, foarte reactiv. Doi atomi de hidrogen isi pun in comun electronii intr-un nor electronic unic ce inconjoara ambele nuclee. Prin forte electrice, norul negativ tine impreuna nucleele pozitive, formind o molecula de hidrogen. Aceast tip de legatura este numit covalenta de catre chimisti. In aerul atmosferic exista moleule de hidrogen, fiecare formata din doi atomi. Acelasi lucru se intimpla si cu oxigenul si azotul.
Moleculele pot fi formate si din atomi diferiti. Astfel, un atom de carbon este legat de doi atomi de oxigen, formind molecula de dioxid de carbon, un alt gaz prezent in aer. Structura moleculei este una liniara, asa cum se vede in desenul de mai jos. |
 |
Oalta molecula formata din doua specii de atomi este cea de apa: un atom de oxigen este legat de doi atomi de hidrogen. De data aceasta, structura orbitalilor atomului de oxigen face ca cele doua legaturi sa nu mai fie coliniare, facind intre ele un unghi de aproximativ 105o. |
   |

In lichid, moleculele sunt "impachetate" mult mai strins decit in cazul unui gaz: distanta medie intre moleculele apei este de aproximativ 0,3nm, de zece ori mai mica decit intre moleculele din aer. Faptul ca molecula de apa este polara este esential in procesele de dizolvare a altor sustante si, in consecinta, in functionarea organismelor vii.
|
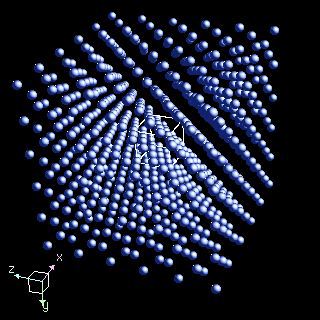
In desenul alaturat este data o reprezentare "schematica" a atomului de cupru ce seamana foarte putin cu atomul real. Reprezentarea retine doar repartizarea electronilor pe straturi, prezentate ca niste orbite circulare. Se vede ca, in afara celor doua straturi complete, exista un singur electron pe stratul exterior. Din acest motiv, el este foarte slab atras de catre nucleu si poate sa paraseasca atomul, care devine ion pozitiv cu sarcina +e. Acest lucru se intimpla in cazul cuprului masiv. Fiecare atom pierde cite un electron, devenind ion pozitiv. Electronii care au parasit atomii formeaza un "ocean de electroni" care se misca liber printre ioni, tinindu-i laolalta. Ionii pozitivi se aranjeaza compact intr-o structura spatiala periodica numita cristal, asa cum se vede in desenul de mai jos. Acest tip special de legatura este numita legatura metalica. Metalele pot fi recunoscute usor datorita modului in care oceanul de electroni reflecta lumina, producind "luciul metalic". |
  |
In filmul urmator puteti urmari o animatie a structurii metalelor.


